特集
日本医科大学の医学研究
ノーベル賞研究の経験から
最先端領域に挑み続ける研究者たち
新しいがん免疫療法につながる物質を発見
―お二人はノーベル賞受賞者のもとで研究してきたという共通点がありますが、どのような研究ですか。
-
岩井:私は医学部を卒業した後、循環器内科の臨床医として働いていましたが、どうしても研究をやりたい気持ちが捨てきれずに研究の道に進むことを決心して、本庶佑先生のラボに入りました。
本庶先生の研究室で発見されたPD-1というタンパク質は、免疫細胞の一つであるT細胞の表面に発現して、免疫のブレーキ役として働きます。PD-1を標的とした免疫療法は、ブレーキを解除することによって免疫力を高めるという逆転の発想によって生まれました。
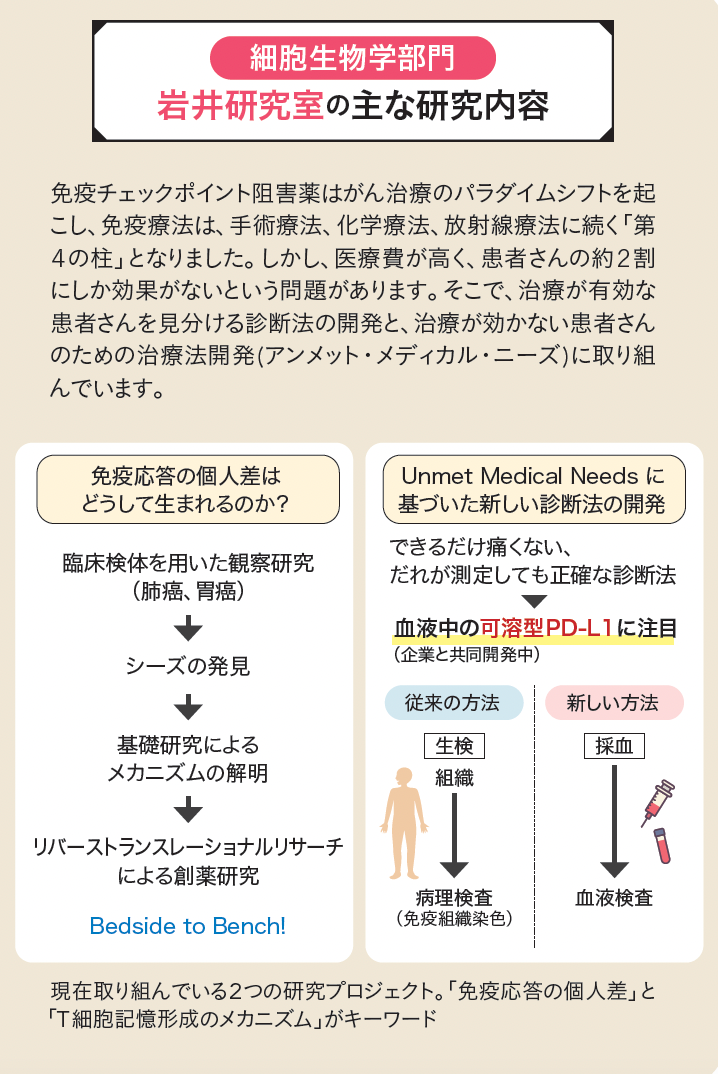
私が本庶ラボで課せられたミッションは、このPD-1に結合する物質を探すことでした。そうして見つけた「PD-L1」はがん細胞上にも発現していて、PD-1とPD-L1が結合することで免疫細胞にブレーキをかけていることがわかりました。次に、これらが結合しないように阻害するPD-1抗体を作りました。この成果により開発されたのが、免疫チェックポイント阻害薬のニボルマブ(商品名オプジーボ)です。
-

岩井佳子先生と本庶佑先生(右)。京都大学大学院医学部の本庶ラボでは免疫抑制分子PD-1の研究に従事。本庶先生(京都大学)とジェームズ・アリソン博士(テキサス大学)は免疫抑制分子を標的としたがん免疫療法の開発により、2018年にノーベル生理学・医学賞を共同受賞した
—本庶先生はPD-1の発見による免疫療法の開発で2018年にノーベル生理学・医学賞を受賞されています。
岩井:そのような大きな研究に、大学院に入学した1年目から関わることができて、とても幸運でした。PD-1抗体の効果を実感したのは、メラノーマ(悪性黒色腫)という黒いがん細胞を用いて、がんの転移実験を行っていたときです。未治療のマウスの肝臓にメラノーマが転移すると真っ黒くなりますが、PD-1抗体を投与したマウスの肝臓は白いままでした。その白い肝臓を見たときに、これはすごい薬になると確信しました。
しかし、当時そのことを学会や論文で発表しても何の反響もありませんでした。本庶先生も製薬会社の説得にとても苦労されていましたが、2006年にがんの臨床試験が始まって効果が示されると、2014年に世界に先駆けて日本で新薬として承認されました。その瞬間から世界的な反響がありました。私は基礎研究で医学に貢献したいという強い思いがあって臨床医から研究者に転身したので、ほかに治療法がない患者さんの命が助かったという話を数多く聞くことができて本当に感動しました。研究者としてこれほど幸せなことはありません。
—岩井先生はもう1人の恩師もノーベル賞を受賞されていると伺いました。
岩井:本当に滅多にないことだと思いますが、2004年から研究留学したときのボスであるラルフ・スタインマン先生も、2011年にノーベル生理学・医学賞を受賞しています。スタインマン先生は免疫の司令塔といわれる樹状細胞の発見者で、私はT細胞への理解を深めるために樹状細胞について知りたいと思い、スタインマン先生に師事しました。
オートファジー研究の最先端領域に挑む
―山本先生が大隅先生のラボに入ったときはどのような状況だったのでしょうか。
-
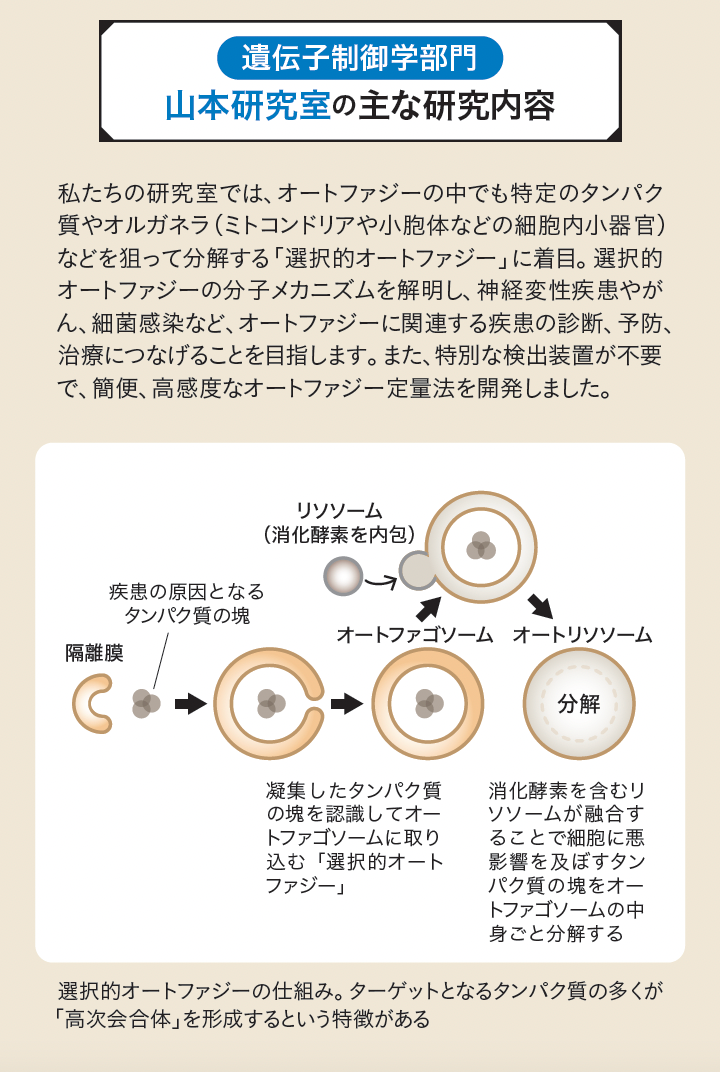
山本:オートファジーというのは、細胞内でタンパク質を分解する仕組み(自食作用)のことです。大隅良典先生は世界で初めてオートファジーのメカニズムを分子レベルで解明したことで2016年にノーベル生理学・医学賞を受賞されました。私が大隅ラボに入ったのはオートファジーの研究がもう一段階進み、オートファジーにはさまざまなバリエーションがあることがわかってきた頃でした。
当初、オートファジーというのは細胞内にあるものをランダムに分解すると考えられていましたが、細胞内で不要になったゴミや傷ついた部分を選んで分解する「選択的オートファジー」の存在が明らかになっています。オートファジーの活性が下がることで細胞内にゴミが溜まり、その結果としてさまざまな病気が発症します。私は、このような細胞内のゴミを認識して効率的に分解するメカニズムの研究を行っており、神経変性疾患やがんの発症メカニズムにも関わると考えています。
-

山本林先生と大隅良典先生(左)。自然科学研究機構基礎生物学研究所、東京工業大学フロンティア研究機構の大隅ラボではオートファジーの分子機構を研究。大隅先生は世界で初めてオートファジーの分子レベルでのメカニズムを解明し、2016年にノーベル生理学・医学賞を受賞した
医学での応用としてはどのようなことが考えられますか。
山本:まずは、細胞内のゴミを効率的に分解する選択的オートファジーの「制御」が挙げられます。また、オートファジーは細胞内で起きている現象ですが、今取り組んでいる選択的オートファジーは細胞外分泌にも関わっているので、その点からも疾患との関わりやメカニズムを解明していこうとしています。私が日本医科大学に赴任してから半年ですが、ありがたいことに臨床の先生方から共同研究のお話をいただいています。 大隅先生のラボでは大隅先生と同じように出芽酵母を使った研究でオートファジーの基礎を学び、その後、哺乳類の培養細胞を使った研究をするようになりました。オートファジーという生命現象に軸足を置いたまま生物種を変えつつ研究していく中で、もっと医学に近いところで研究したいという気持ちが強くなっていきました。なので、今こうして医学や臨床に近いところで研究できるようになったことは、とても幸福なことだと感じています。
偉大な研究者との研究で得られたものとは
―ボスがノーベル賞を受賞したことでどのような影響がありましたか。
岩井:ノーベル賞を取ったことが個人の研究者に与える影響はほとんどありませんが、とにかく反響が大きくて、これまでまったく接点のなかった多くの人と出会う機会に恵まれました。研究者だけでなく、企業や一般の方もそうですし、オープンキャンパスでは、多くの学生さんが目をキラキラと輝かせながら話を聞いてくれて、とても嬉しかったです。これまではごく限られた研究者だけの狭い世界しか知らなかったので、新しい出会いによって世界が広がり、とても新鮮でした。
山本:私もまったく同じです。大隅先生がノーベル賞を受賞されたときには、オートファジー研究はかなり成熟していて、すでに次の段階に進んでいました。ノーベル賞受賞によって一般の方にも広く知ってもらえて、中にはこちらが驚くほどの知識を持っている高校生もいました。いろいろな人とのつながりができたということでは研究面にも影響があり、それまではなかなか共同研究がなかったような他分野の研究者から声を掛けていただくことが増えました。それが私としてはとても刺激になっています。
—山本先生と岩井先生はまったく別の研究分野のように見えますが、どのようなつながりがあるのでしょうか。
岩井:私が専門とする免疫系の研究では、免疫細胞の増減や免疫細胞が産生するサイトカインのシグナルに注目しがちですが、私は細胞の中で起こっていることも知りたいと思っています。そのための手法などについて山本先生に相談したりしています。私たちがいる先端医学研究所には、山本先生のように最先端の技術を持った研究者がたくさんいますので、さまざまな分野と関わることで研究を発展させたいと考えています。
山本:私にとっては臨床に近いところで研究できることが魅力で、日本医科大学には専門とする疾患について分子レベルで理解したいと声を掛けてくれる臨床医がたくさんいます。この研究所は臨床と基礎研究の架け橋になる役割も担っていると思っていますが、そのような考え方も私と岩井先生はかなり近いので、さまざまなことを一緒にやっていきたいと話しています。
岩井:共同研究をするときは研究者同士の興味が一致していることはもちろんのこと、それぞれの専門分野が遠ければ遠いほど化学反応が起こり、刺激を受けます。これからが楽しみですね。
自分たちの研究成果が多くの人を救うと信じて
―現在取り組んでいるのはどのような研究でしょうか。
山本:選択的オートファジーの分子メカニズムの解明を中心に、血液内科など臨床の医師たちとともにタンパク質の機能レベルでの疾患メカニズム解明にも取り組み始めたところです。また、従来の蛍光タンパク質を使ってオートファジーをイメージングする方法より、さらに簡便かつ正確にオートファジーを定量化するプローブを開発しました。このプローブは選択的オートファジーで分解されるタンパク質の中でも特定のタンパク質だけを狙って分解過程を見ることができるので、多くの研究者に使ってもらって研究の裾野を広げたいと考えています。
岩井:免疫チェックポイント阻害薬はがん治療に革命を起こしましたが、残念ながらこの薬が効くのは2割から3割の患者さんだけです。このような効果の違いを引き起こす「免疫応答の個人差」がなぜ起こるのか、そのメカニズムを調べるとともに、がん免疫療法が効く人と効かない人を事前に見分ける診断方法を開発するための研究を行っています。免疫応答の個人差は、新型コロナ感染症の重症度や後遺症にも関係する重要な研究テーマだと考えています。
—今後、ご自分の研究をどのような方向に進めていこうとお考えですか。
-

-
岩井:従来の医学研究では動物や培養細胞を使って有効性や安全性を確認してからヒトへの臨床応用へと進みますが、ヒトの個人差をマウスで調べることはできません。個人差の問題に取り組むには、ヒトの臨床検体を用いた研究が欠かせないので、今は臨床研究に集中しています。そして、臨床研究で鍵となる現象を捉え、その現象を動物や培養細胞で証明する「リバーストランスレーショナルリサーチ」を進めています。すでに面白そうな現象をいくつか発見していますので、できれば山本先生が得意とされている細胞内のスケールまで解明したいと思っています。
山本:今のところオートファジーの薬はありませんが、単純なオートファジー活性の底上げでは必要なものまで分解されてしまう恐れがあります。そういうことも含めて、不要なモノを狙って分解できる「選択的オートファジー」を治療に役立てる道を探っていきたいと考えています。例えば、神経変性疾患のようにオートファジーに関する症状があらわれる前にオートファジーの活性を上げる「予防」というアプローチがありえます。また、オートファジーの状態を診断する方法を開発し、早期発見やオートファジー活性を高める薬の開発につなげていきたいと考えています。

山本 林先生(やまもと・はやし)
日本医科大学先端医学研究所
遺伝子制御学部門 大学院教授
1999年名古屋大学理学部化学科卒業。2004年同大学大学院理学研究科博士課程を修了し、博士号取得(理学博士)。2006年から基礎生物学研究所で大隅良典先生のもとでオートファジーの研究を始め、東京工業大学フロンティア研究機構でも大隅ラボに所属。東京大学大学院医学系研究科講師を経て、2022年より現職。

岩井 佳子先生(いわい・よしこ)
日本医科大学先端医学研究所
細胞生物学部門 大学院教授
1996年東京医科歯科大学医学部卒業。同大学医学部附属病院で勤務後、京都大学大学院医学研究科博士課程に進学。本庶佑先生のもとで基礎研究を始める。2002年博士号取得(医学博士)。2004年米国ロックフェラー大学に留学し、ラルフ・スタインマン博士のもとで研究。帰国後は東京医科歯科大学准教授、産業医科大学医学部教授を経て、2017年より現職。